锶(Sr)
锶:银白色软金属,密度2.6克/厘米3。熔点769℃。沸点1384℃。化合价+2。第一电离能5.695电子伏特。化学性质活泼,于空气中加热时能燃烧;易与水和酸作用而放出氢;在到熔点时即燃烧而呈红色火焰。1808年,英国的克劳福特和戴维先后由铅矿和锶矿中发现了锶。
锶是碱土金属中丰度最小的元素。主要的矿物有天青石和碳酸锶矿。可由电解熔融的氯化锶而制得。用于制造合金、光电管,以及分析化学、烟火等。质量数90的锶是一种放射性同位素,可作β射线放射源,半衰期为25年。钡、锶、钙和镁同是碱土金属,也是地壳中含量较多的元素。不过钡和锶在地壳中的含量与钙、镁相比,还是较少的。再加上它们的化合物的实际应用不及钙和镁的化合物广泛。因此它们的化合物比钙和镁的化合物晚些被人们认识,只是戴维把钡和锶和钙、镁同时从化合物中电解分离出来。 | 元素名称 | 锶 | 元素符号 | Sr | 原子序数 | 38 | 相对原子质量
(12C=12.0000) | 87.62 | | 英文名称 | Strontium | | 原子结构 | 原子半径(Å) | 2.45 | 原子体积(cm3/mol) | 33.7 | 电子模型 | 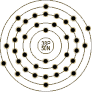
| | 电子构型 | 1s2 2s2p6 3s2p6d10 4s2p6 5s2 | 离子半径(Å) | 1.12 | | 共价半径(Å) | 1.91 | 氧化态 | 2 | | 发现 | 1790年, A. Crawford(苏格兰,爱丁堡)认为锶是一种元素, 1808年, 由 Humphry Davy (英国,伦敦)分离出。 | | 命名起源 | after the village of 'Strontian', Scotland | | 来源 | 存在于矿物天青石(celestite)和菱锶矿(strontianite)中。 | | 用途 | 用于焰火,具有洋红色火焰。也用于核能电池。 | | 物理性质 | 状态 | 软的银黄色金属。 | 熔 点(℃) | 769 | 沸 点(℃) | 1384 | | 密度(g/cc,300K) | 2.54 | 比 热(J/gK) | 0.3 | 蒸发热(KJ/mol) | 144 | | 熔化热(KJ/mol) | 8.3 | 导电率(106/cm) | 0.0762 | 导热系数(W/cmK) | 0.353 | | 自燃点(℃) | - | 闪 点(℃) | - | | | | 化学性质 | | | 地质数据 | 丰 度 | | 滞留时间(年) | 4×106 | 太阳
(相对于 H=1×1012) | 790 | | 海水中(ppm) | - | 地壳(ppm) | 370 | 大西洋表面 | 7.6 | | 太平洋表面 | 7.6 | 大气(ppm(体积)) | - | 大西洋深处 | 7.7 | | 太平洋深处 | 7.7 | | | | | | 生物数据 | 人体中含量 | | 肝(ppm) | 0.05-0.36 | | 器官中 | | 肌肉(ppm) | 0.12-0.35 | | 血(mg dm-3) | 0.031 | 日摄入量(mg) | 0.8-5 | | 骨(ppm) | 36-140 | 人(70Kg)均体内总量(mg) | 320 |
锶的同位素信息 | 同位素 | % | 质量 | 自旋 | 核磁矩 | 磁旋比 | Q | 频率 | 吸收率 | | 84 | 0.56 | 83.913426 | | | | | | | | [85] | 0 | 84.912933 | | | | | | | | 86 | 9.86 | 85.909265 | | | | | | | | 87 | 7 | 86.908882 | 9/2 | -1.2090236 | -1.1639376 | 33.5 | 4.333822 | 1.90×10-4 | | 88 | 82.58 | 87.905617 | | | | | | | | [89] | 0 | 88.907452 | | | | | | | | [90] | 0 | 89.9077376 | | | | | | |
| |
您可能感兴趣的产品:
石油中铍,铋,钴,钾,锂,锑,钪,硒,锶,钨,钇,锆质控样品
|