分析化学中的四种滴定分析方法,分别是:氧化还原滴定、络合滴定、酸碱滴定、沉淀滴定。
四种滴定分析方法的区别主要是反应的类型和是否便于测定。比如,氧化还原滴定主要用于氧化还原反应;沉淀滴定主要用于反应中产生沉淀的反应;酸碱滴定主要用于酸性物质与碱性物质的反应或者广义上的路易士酸碱;络合滴定主要用于络合反应的滴定。
1、氧化还原滴定法
氧化还原滴定法是以氧化还原反应为基础的容量分析方法。它以氧化剂或还原剂为滴定剂,直接滴定一些具有还原性或氧化性的物质;或者间接滴定一些本身并没有氧化还原性,但能与某些氧化剂或还原剂起反应的物质。应用较为广泛的有:碘量法、溴量法、铈量法、亚硝酸钠法、高锰酸钾法和重铬酸钾法等。
2、络合滴定法
络合滴定分析方法,又称配位滴定,是以络合反应 (形成配合物)反应为基础的分析方法。络合反应广泛地应用于分析化学的各种分离与测定中,许多显色剂、萃取剂、沉淀剂和掩蔽剂等都是络合剂。
3、酸碱滴定法
强酸和强碱在溶液中是完全离解的,酸以H+形式存在,碱以OH-形式存在。酸碱滴定法是以酸、碱之间质子传递反应为基础的一种滴定分析法,可用于测定酸、碱和两性物质。其基本反应为
H+ + OH- = H2O
该方法也称中和法,是一种利用酸碱反应进行容量分析的方法。用酸作滴定剂可以测定碱,用碱作滴定剂可以测定酸,这是一种用途极为广泛的分析方法。
4、沉淀滴定法
沉淀滴定法是利用沉淀反应进行容量分析的方法。生成沉淀的反应很多,但符合容量分析条件的却很少,实际上应用最多的是银量法。
四种滴定分析方法的异同点:
1、共同点
1) 都是以消耗计算量的标准物质来测定被测物质含量的。
2) 随着滴定剂的加入,被滴定物质的浓度在计量点附近会有突变(突跃),可以用这一突变,或通过这一突变导致指示剂的变色来制定滴定终点。
3) 滴定分析终点误差Et的定义都可以表示为:
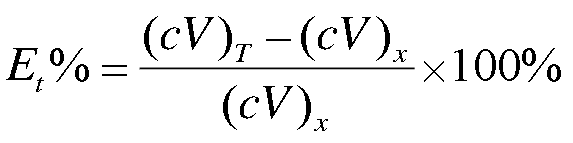
4) 由于历史遗留问题四者使用的常数不同,若都用滴定常数Kt,可使四种滴定数学处理趋于一致。
2、不同点
1) 强酸强碱的滴定产物为水,从滴定未开始到滴定结束,H20一直是一个常数,约为55.5mol/L。
2) 沉淀滴定有异相生成随着滴定的进行,一旦有沉淀生成他的活度就被制定为1,并且保持不变。
3) 络合滴定产物ML的浓度在滴定过程中是一变数开始时为0,随着滴定的进行,ML的浓度近线性的增大,直至化学计量点。
4) 最简单的氧化还原反映的滴定产物有两种,他们在滴定过程中的浓度变化与络合滴定产物ML相似。所以从这一意义上,可把滴定分析分为两种,一种是滴定产物的浓度为常量的,如强酸强碱滴定、沉淀滴定;一种是产物为变数的,如络合和氧化还原滴定。